Autoria: Filipa Sousa¹, Pedro Mateus¹ , Maria Martins¹, Bruno Sousa¹, José Moutinho-Pereira², Cristiano Soares¹, Fernanda Fidalgo¹
¹ GreenUporto- Sustainable Agrifood Production Research Center & INOV4AGRO, Biology Department, Faculty of Science, University of Porto
² CITAB- Centre for the Research and Technology of Agro-Environmental and Biological Sciences, Universidade de Trás-os-Montes e Alto Douro
A importância do castanheiro em termos nacionais é inquestionável. Atualmente, Portugal é o quarto maior produtor de castanha na Europa e um dos maiores exportadores deste fruto a nível mundial, com uma área de cultivo e produção que totalizou, em 2022, cerca de 50 000 ha e 29 000 t, respetivamente [1].
Na Europa, o castanheiro (Castanea sativa Miller) é considerado uma cultura mediterrânica, sendo sensível a longos episódios de calor e secura [2,3], cenários cada vez mais comuns sobretudo durante os meses de Verão, devido às alterações climáticas (AC). Na verdade, as AC são consideradas o principal desafio à sustentabilidade dos ecossistemas, levando frequentemente as plantas para situações que excedem os seus limites de tolerância. De facto, dada a redução dos níveis de precipitação, assim como as temperaturas elevadas observadas em algumas áreas, o crescimento e o rendimento das culturas estão já a ser significativamente condicionados, especialmente na instalação e estabelecimento de novos soutos. Apesar das respostas de C. sativa a stresses individuais, como a falta de água e as temperaturas elevadas, estarem relativamente bem caracterizadas em temos ecofisiológicos, os efeitos da co-exposição à secura e ao calor no crescimento e fisiologia desta espécie permanecem por explorar, reconhecendo-se, contudo, que a combinação de stresses abióticos pode resultar em consequências agravadas para o desempenho das plantas.
Este estudo revela-se especialmente importante no panorama nacional, habitat de diversos ecótipos de C. sativa, com elevado valor comercial e biológico.
Além disso, pode representar o ponto de partida para o desenvolvimento de estratégias de mitigação de stress, de modo a promover a resiliência do castanheiro às AC e garantir a sustentabilidade e a competitividade económica da produção da castanha em Portugal. Neste contexto, a micorrização tem vindo a emergir como uma estratégia promissora de fácil implementação, capaz de promover a tolerância das plantas a vários tipos de stress [4]. Esta associação simbiótica entre fungos micorrízicos e as raízes das plantas resulta em diversos benefícios, especialmente sob condições adversas, aumentando a absorção de água e nutrientes pelas plantas e limitando alguns dos efeitos negativos do stress [5].
Neste sentido, o presente trabalho pretendeu avaliar se a resposta fisiológica de C. sativa à combinação da secura e temperaturas elevadas é diferencialmente modulada pela presença de associações micorrízicas.
Para tal, plantas micropropagadas de castanheiro (cv. Marsol) não micorrizadas (NMR) e micorrizadas (MR) com Paxillus involutus, um fungo autóctone oriundo de soutos portugueses, foram expostas a situações individuais e combinadas de calor (42ºC; 4h d-1) e secura (paragem da irrigação até se atingir 25% da capacidade máxima de retenção de água no substrato) durante 21 dias, para avaliação da resposta fisiológica, bioquímica e da atividade fotossintética.
Resultados
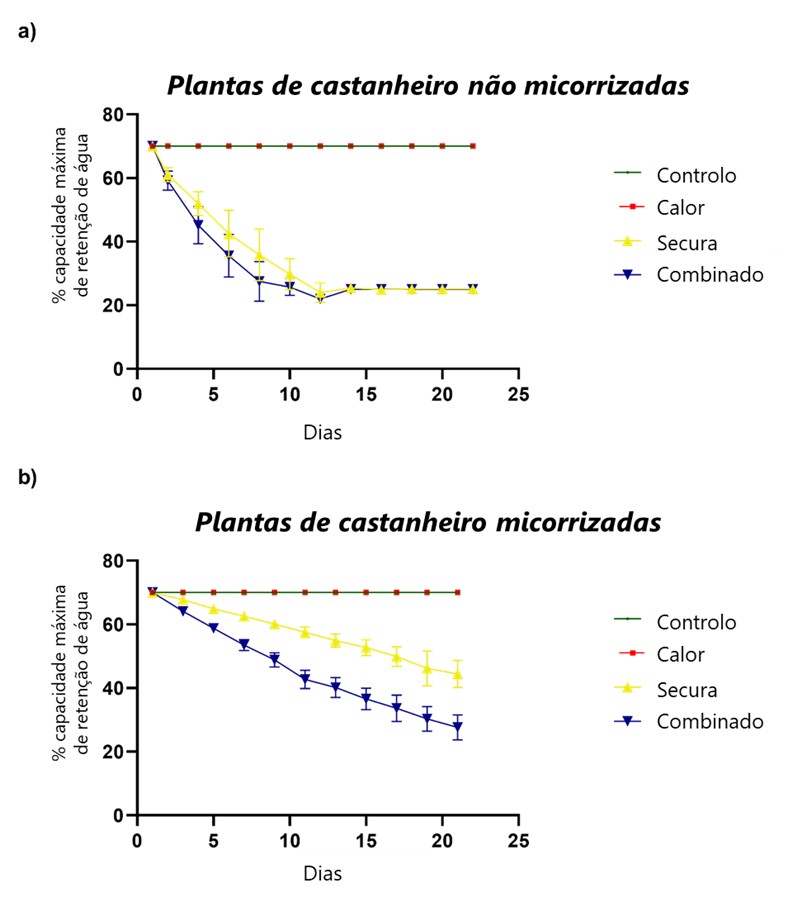
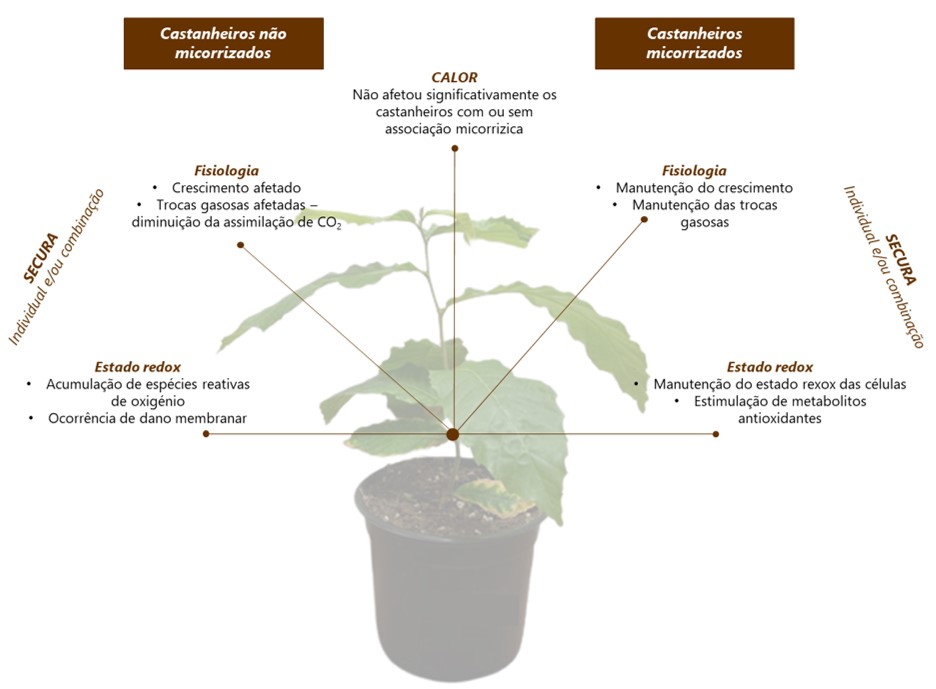
Os resultados revelaram que o tratamento por calor, individualmente, não afetou negativamente o crescimento, a atividade fotossintética, nem induziu stress oxidativo, tanto nas plantas MR, quanto nas NMR. Por outro lado, a secura, tanto isoladamente, como em co-exposição com o calor, comprometeu de forma acentuada o crescimento das plantas NMR, afetando significativamente o conteúdo relativo de água, a produção de novas folhas e a área foliar. Em contraste, a associação com ectomicorrizas (ECM) mitigou de forma eficiente parte destes efeitos, apresentando as plantas MR expostas ao calor e à secura padrões de crescimento semelhantes aos das plantas controlo. Além disso, mesmo na situação de stresses combinados, as plantas MR foram menos suscetíveis do que as NMR, apresentando uma menor taxa de inibição do crescimento. Adicionalmente, tal como é possível observar na Figura 1, as plantas NMR mostraram perdas de água no substrato muito acentuadas, e a um ritmo mais acelerado do que as plantas com associação ectomicorrízica, evidenciando o papel do fungo na retenção da água no substrato. Este fator terá, certamente, contribuído para uma mitigação dos efeitos do stress nas plantas MR, permitindo diminuir a severidade dos impactos observados. Corroborando as evidências macroscópicas e dados biométricos, o estudo do metabolismo fotossintético revelou que as trocas gasosas das plantas NMR foram acentuadamente afetadas pela escassez de água, o que resultou numa redução da assimilação do dióxido de carbono (CO2 ). Contrariamente, a presença das ECM assegurou a manutenção das trocas gasosas nas plantas expostas a condições de secura, e induziu um aumento da assimilação de CO2 e uso eficiente de água.
A secura é o fator de stress que mais compromete o crescimento e o desenvolvimento de plantas jovens de castanheiro.
Com o objetivo de relacionar os efeitos observados com possíveis danos oxidativos, o metabolismo redox foi avaliado nas raízes e folhas de plantas MR e NMR expostas a ambos os fatores de stress isoladamente e em combinação. De uma forma geral, comparativamente às raízes, as folhas das plantas NMR e MR foram mais suscetíveis ao dano oxidativo. A secura, tanto individualmente, quanto em combinação com o calor, induziu stress oxidativo nas plantas NMR, evidenciado pelo aumento na produção de espécies reativas de oxigénio (ROS) e pelo dano membranar, avaliado através do grau de peroxidação lipídica. Por outro lado, as plantas MR expostas ao stress combinado conseguiram evitar o stress oxidativo ao ativar mecanismos de defesa, acumulando diversos metabolitos antioxidantes, como a prolina, a glutationa e o ascorbato.
Em suma, os resultados deste trabalho (sumarizados na Figura 2) demonstraram, inequivocamente, que a secura é o fator de stress que mais compromete o crescimento e o desenvolvimento de plantas jovens de castanheiro, com uma amplificação desses efeitos pela co-exposição a elevadas temperaturas. Contudo, a associação com ECM permitiu aliviar parte desses efeitos ao promover o crescimento, melhorar as relações hídricas, aumentar a atividade fotossintética e estimular diferentes mecanismos de defesa antioxidante.
Pela primeira vez, foram caracterizados os impactos combinados do calor e da secura em C. sativa, dando também um passo no estudo do potencial da micorrização como estratégia futura para aumentar a resiliência do castanheiro aos desafios impostos pelas AC.
→ Leia este e outros artigos na Revista Voz do Campo: edição de junho 2024
Referências
[1] Food and Agriculture Organization of the United Nations (FAO). FAOSTAT Statistical Database. Available online: https:// www.fao.org/faostat/en/#data (Maio 06, 2024).
[2] Gomes-Laranjo, J.; Dinis, L..T.; Marques, T.; Mota, M.; Carvalho, A.; Pinto, T.; Anjos, R.; Martins, L.; Marques, G.; Gaspar, M.J.; et al. Increasing chestnut resilience to climate change with innovative management practices. In Proceedings of the Acta Horticulturae; International Society for Horticultural Science (ISHS), Leuven, Belgium, 2018, 163–176.
[3] Perulli, G.D.; Boini, A.; Bresilla, K.; Morandi, B.; Grappadelli, L.C.; e Manfrini, L.. Growth analysis of sweet chestnut burr in two seasons with differing weather conditions. Italus Hortus 27, 31–39. doi: 10.26353/j.itahort/2020.1.3139
[4] Siddiqui, Z.A.; Akhtar, M.S.; e Futai, K.. Mycorrhizae: Sustainable agriculture and forestry. 2018, 1–359. doi: 10.1007/978-1-4020-8770-7
[5] Mol, R.; Karthika, K.S.; Philip P.; e Chandrakala M.. Soil Mycorrhiza: Overview, Evolution, Agricultural, and Commercial Applications. Industrial Applications of Soil Microbes. 2024, 149-160. doi:10.2174/9789815079753124030011
Agradecimentos
Este trabalho foi desenvolvido no âmbito do projeto CC&NUTS (ref. PD21-00007), cofinanciado pelo BPI e Fundação “la Caixa” e Fundação para a Ciência e Tecnologia (FCT). Este estudo foi também parcialmente apoiado por fundos nacionais através da FCT, no âmbito dos ptojetos estratégicos UIDB/05748/2020 e UIDP/05748/2020 (GreenUPorto),
https://doi.org/10.54499/UIDP/05748/2020 e https://doi. org/10.54499/UIDB/05748/2020 e UIDB/04033/2020 and UIDP/04033/2020 (CITAB), https://doi.org/10.54499/ UIDB/04033/2020. FS, BS e MM agradecem à FCT pelas bolsas de doutoramento: 2021.04941.BD, 2020/07826/BD e SFRH/ BD/143268/2019, respetivamente.
Os autores agradecem à Deifil Biotechnology Lda© a disponibilidade das plantas utilizadas neste trabalho.