Fenotipagem de plantas, melhoramento e alterações climáticas
A fenotipagem de plantas é uma disciplina emergente que combina várias metodologias e protocolos para medir características vegetais, como crescimento, arquitetura, função e composição, em várias escalas de organização biológica. Quando feita manualmente é um processo muito demorado e que exige grande quantidade de mão de obra, pelo que representa um dos principais constrangimentos à fenotipagem de plantas e culturas com objetivos de melhoramento. Atualmente já existem métodos de ‘fenotipagem de plantas de alto rendimento’ (HTPP), geralmente baseados em captura de imagens, obtenção automatizada de dados e processamento. Mesmo com a automatização da HTTP, ainda existem desafios e nem todos os métodos são adequados ao processo de seleção de plantas em culturas economicamente relevantes, como a videira.
As alterações climáticas (menor precipitação, temperaturas mais elevadas, maior frequência de eventos extremos) são um sério risco para a sustentabilidade do setor vitivinícola, diminuindo a produtividade e a qualidade, promovendo a senescência e queda precoce das folhas, bem como aumentando a incidência de queimaduras solares em folhas e cachos. O uso de rega tem sido a principal estratégia para enfrentar o desafio climático, mas outras estratégias, mais sustentáveis, tais como a obtenção e seleção de castas e porta enxertos mais resistentes, também podem ser usadas.
Fenotipagem da videira
A videira é uma espécie com grande diversidade genética que precisa de ser bem caracterizada, pois em cada variedade existem alguns genótipos (clones) que são mais tolerantes do que a média da variedade, ao stresse abiótico. É assim necessário apoiar a seleção com a disponibilização de métodos eficazes de identificar este material vegetal mais bem adaptado ao stresse abiótico para uso posterior (material policlonal ou clonal). Este processo envolve a observação de centenas ou milhares de indivíduos no campo. Além de demorados, complexos e dispendiosos, estes ensaios são também afetados por condições de clima e solo heterogéneas e difíceis de controlar. Deste modo, o planeamento cuidadoso do projeto experimental de campo e as metodologias de colheita de dados em campo são cruciais para obter resultados confiáveis. O fenótipo é a parte visível do genótipo. É definido como o resultado do genótipo, do ambiente e da interação entre eles (G × E) e é dinâmico, complexo e compreende múltiplos traços quantitativos e qualitativos que dificultam o seu estudo. A fenotipagem engloba o conjunto de metodologias e protocolos usados para medir com precisão fenótipos de crescimento, arquitetura, composição e função das plantas, e visa fornecer dados para melhorar a gestão dos recursos de biodiversidade, promover a adaptação das culturas ao ambiente, bem como identificar características superiores de, por exemplo, rendimento, qualidade, ou tolerância a stresses bióticos e abióticos.
O fenótipo é a parte visível do genótipo. É definido como o resultado do genótipo, do ambiente e da interação entre eles (G × E) e é dinâmico, complexo e compreende múltiplos traços quantitativos e qualitativos que dificultam o seu estudo. A fenotipagem engloba o conjunto de metodologias e protocolos usados para medir com precisão fenótipos de crescimento, arquitetura, composição e função das plantas, e visa fornecer dados para melhorar a gestão dos recursos de biodiversidade, promover a adaptação das culturas ao ambiente, bem como identificar características superiores de, por exemplo, rendimento, qualidade, ou tolerância a stresses bióticos e abióticos.
Uma fenotipagem eficiente deve considerar dois aspetos muito importantes: 1) a disponibilidade de ferramentas adequadas para medir as características-alvo e 2) o planeamento das medições. Quanto ao primeiro aspeto, a seleção de plantas necessita de métodos simples, rápidos e fáceis de usar em larga escala (para medição de centenas e mesmo milhares de indivíduos), adaptados às principais características agronómicas, fisiológicas e tecnológicas. O segundo aspeto prende-se com as ações tomadas antes e depois da fenotipagem, ou seja, as regras a seguir para garantir que os dados obtidos sejam adequados para efeitos de seleção.
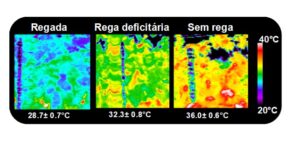
Sendo a videira uma espécie perene, com copa e arquitetura complexas, a fenotipagem de campo apresenta dificuldades, que o uso de sistemas de imagem com capacidade de identificar situações de stresse tem vindo progressivamente a colmatar. Um exemplo é a análise de imagem por RGB, usada para estimar rendimento, área foliar e vigor, havendo já métodos disponíveis capazes de distinguir uvas com base na forma, o que permite quantificar uvas de castas brancas tão eficientemente como tintas. Já a imagem de infravermelhos térmica (termografia) é muito utilizada tanto em fenotipagem como na monitorização de stresse hídrico em condições de campo, pois permite monitorizar o grau de abertura estomática e a transpiração através da medição da temperatura à superfície das folhas na copa. Quando as plantas têm água disponível, a temperatura das folhas é mais baixa devido à água perdida por transpiração (arrefecimento evaporativo). Já em situação de falta de água as plantas tendem a gerir a pouca água disponível, fechando os estomas e transpirando menos, o que aumenta a temperatura das folhas. Há vários índices de eficiência de uso de água que podem ser obtidos a partir deste tipo de imagem e atualmente existem aplicações para smartphone que captam e analisam imagens térmicas permitindo a gestão da rega em tempo real e a caracterização do comportamento de plantas diferentes para fenotipagem.
Já a obtenção de parâmetros de fluorescência da clorofila constitui uma abordagem mais robusta e que fornece informação detalhada sobre os mecanismos fisiológicos de resposta o stresse. No entanto, a sua medição é mais complexa e exige alguma preparação do material a medir (adaptação da planta ao escuro), o que não é compatível com medições expeditas de campo. No entanto, a aquisição da assinatura espectral de fluorescência da clorofila após excitação por laser (LIF, fluorescência induzida por laser) não requere adaptação ao escuro nem contacto do sensor com a amostra, o que poderá permitir uma utilização em fenotipagem no campo (…).
→ Leia o artigo completo na Revista Voz do Campo: edição de março 2024
Autoria: Luísa C Carvalho¹ , Elsa F Gonçalves¹,², Jorge Marques da Silva³, J Miguel Costa¹
¹ LEAF — Research Center, Instituto Superior de Agronomia, Universidade de Lisboa, Lisboa, Portugal
² Associação Portuguesa para a Diversidade da Videira – PORVID
³ BioISI – Biosystems and Integrative Sciences Institute, Faculty of Sciences, Universidade de Lisboa, Lisboa, Portugal
lcarvalho@isa.ulisboa.pt; elsagoncalves@isa.ulisboa.pt; jmlsilva@ciencias.ulisboa.pt; miguelcosta@isa.ulisboa.pt